Buňka, stejně jako lidské tělo, podléhá v nepříznivých podmínkách stresu. Protein ATF4 představuje důležitý nástroj k tomu, aby se buňka dokázala se stresem vyrovnat. „Protistresovým“ proteinem a mechanismem jeho produkce se deset let zabývala Laboratoř genové exprese v Mikrobiologickém ústavu AV ČR. Vědci do detailu popsali molekulární mechanismus, kterým buňka protein tvoří, a to pouze v okamžiku, kdy se ocitne ve stresové situaci.
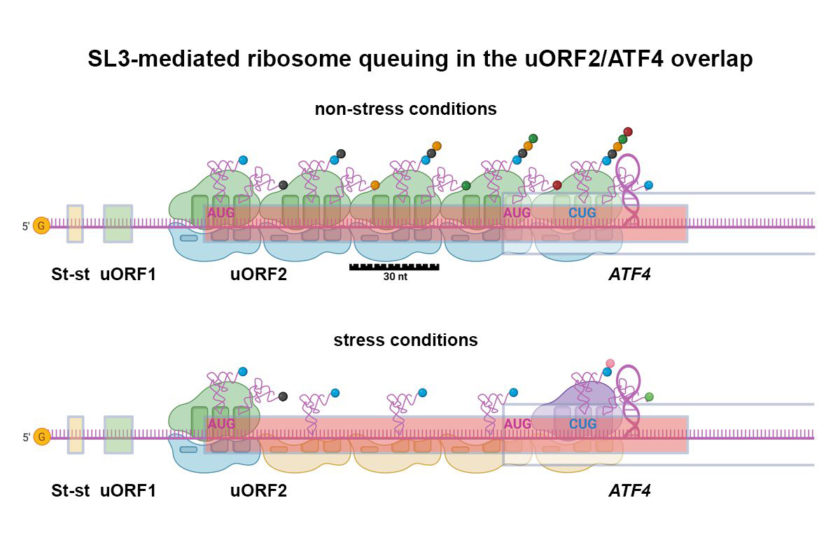
„Zatímco během stresové situace se syntéza velké většiny proteinů v buňce prakticky zastaví, syntéza ATF4 se naopak rozjede na plno. Děje se tak díky speciálním regulačním prvkům, které se nachází na začátku mRNA, která tento protein kóduje.“ vysvětluje vedoucí laboratoře Leoš Shivaya Valášek z Mikrobiologického ústavu AV ČR.
Protein, který řídí osud stresovaných buněk
Buňky si jako reakci na stresové situace vyvinuly různé mechanismy. Příkladem jsou signální dráhy, které po aktivaci cíleně ovlivňují a mění chování buňky.
Právě ATF4 protein je klíčovým průsečíkem několika takových signálních drah, který udává, co se se stresovanou buňkou stane hned v několika ohledech.
„Tento protein umožní buňce v okamžiku úplně přeprogramovat její činnost, aby všeho nechala a veškerou energii soustředila na vyrovnání se s daným stresem. Pokud se jí to v přesně daném časovém okamžiku nepodaří, ATF4 spustí tzv. programovanou buněčnou smrt, aby se takto stresovaná buňka nestala pro své okolí nebezpečnou – např. zhoubnou, tedy nekontrolovaně se dělící,“ vysvětluje Anna Smirnová z Mikrobiologického ústavu AV ČR.
Nově popsaný mechanismus významně rozšiřuje předchozí teorii
Mechanismus, jakým buňka ve stresových situacích ATF4 syntetizuje, popsaly ve dvou prestižních publikacích už v roce 2004 hned dvě vědecké skupiny – skupina Dr. Ronalda Weka v Indiana University School of Medicine a skupina Dr. Davida Rona v University of Cambridge.
„Dlouho se pak mělo za to, že tato mnoho let trvající záhada byla jednou pro vždy vyřešena. Časem se ale začaly hromadit výsledky jiných studií, které naznačovaly, že molekulární mechanismus regulace syntézy tohoto důležitého bojovníka proti stresu je mnohem složitější, než se původně zdálo,“ říká Valášek.
Na základě těchto studií začali vědci v Mikrobiologickém ústavu AV ČR jejich desetiletý výzkumný projekt. „Shodou okolností den poté, co byl tento článek přijat, přednášel člen Britské královské společnosti David Ron na Ústavu Organické Chemie a Biochemie AV ČR jako zvaný řečník. Sešel jsem se s ním a čerstvě přijatý manuskript mu předal s věnováním a přáním, aby mu cesta zpět domů s tímto manuskriptem v ruce rychle utekla“, dodává Valášek.
Přizpůsobení budoucích terapií
Objev je důležitý při zkoumání nových léčebných terapií. „Vzhledem k tomu, že deregulovaná syntéza ATF4 provází různé patologické stavy, včetně nádorových onemocnění, naše práce jasně ukazuje, že při zvažování vhodných terapií, které cílí na ATF4, je třeba brát na zřetel komplexnost kontroly syntézy tohoto klíčového regulátoru života či smrti stresovaných buněk,“ doplňuje Valášek.
Kontakt:
dr. rer. nat. Leoš Shivaya Valášek, DSc.
Mikrobiologický ústav AV ČR