Biogeneze a kontrola kvality chlorofyl-proteinových komplexů
Naše skupina, vedená prof. Josefem Komendou, se zaměřuje na studium biogeneze a kontroly kvality chlorofyl (Chl)-proteinových komplexů zabudovaných v tylakoidních membránách, tedy fotosystému I (PSI) a fotosystému II (PSII). Fotosystémy jsou zodpovědné za kyslíkovou fotosyntézu, biochemický proces nezbytný pro evoluční vývoj a udržení života na Zemi. Na těchto komplexech dochází ke světlem indukované separaci náboje, vedoucí k redukci NADP+ a tvorbě pH gradientu využitého pro produkci ATP. Vzhledem k velkému počtu proteinových podjednotek a také kofaktorů včetně Chl, karotenoidů, hemového a nehemového železa, lipidů, iontů atd. patří oba fotosystémy mezi nejsložitější enzymy v přírodě. Díky pokrokům ve strukturní biologii známe jejich detailní struktury (Jordan et al., 2001; Umena et al., 2011), ale méně je prozkoumaný je komplikovaný proces jejich biogeneze, vyžadující přísnou regulaci a kontrolu kvality.


Jako experimnetální model používáme glukózo-tolerantní kmen sinice Synechocystis PCC. 6803, který s vyznačuje rychlým růstem, přirozenou transformabilitou a možností kultivace na glukóze, pokud jsou vyřazeny geny nezbytné pro fotosyntézu. Díky těmto vlastnostem je Synechocystis vynikajícím modelem pro studium základních procesů na fotosyntetických membránách společných pro sinice, řasy i rostliny. Využíváme moderní metody molekulární biologie, biochemie proteinů a zobrazování buněk, a ve spolupráci s partnery i pokročilou strukturní biologii.
Náš výzkum je v současné době podporován projekty uvedenými zde a zde.
Biogeneze fotosystému II
PSII vzniká postupným sestavením ze čtyř subkomplexů (modulů). Každý z nich se skládá z jedné z velkých Chl-proteinových podjednotek (t.j. klíčových proteinů reakčního centra označovaných D1 a D2, a vnitřních antén CP43 a CP47), přilehlých malých transmembránových podjednotek a pomocných (assembly) faktorů (AF), které usnadňují jednotlivé kroky sestavování (Komenda, Sobotka and Nixon, 2012). AF jsou většinou specifické pro určitý krok biogeneze, a mezi jejich úlohy patří stabilizace protein-proteinových interakcí, ochrana vznikající struktury před předčasnou degradací nebo světelným poškozením a podpora inzerce Chl a dalších kofaktorů. Pro podrobnější vhled do naší práce na toto téma viz např. Komenda et al. (2012), Knoppová et al. (2014), Bečková et al. (2017), Bučinská et al. (2018), Pascual-Aznar et al. (2021), Knoppová et al.(2022).
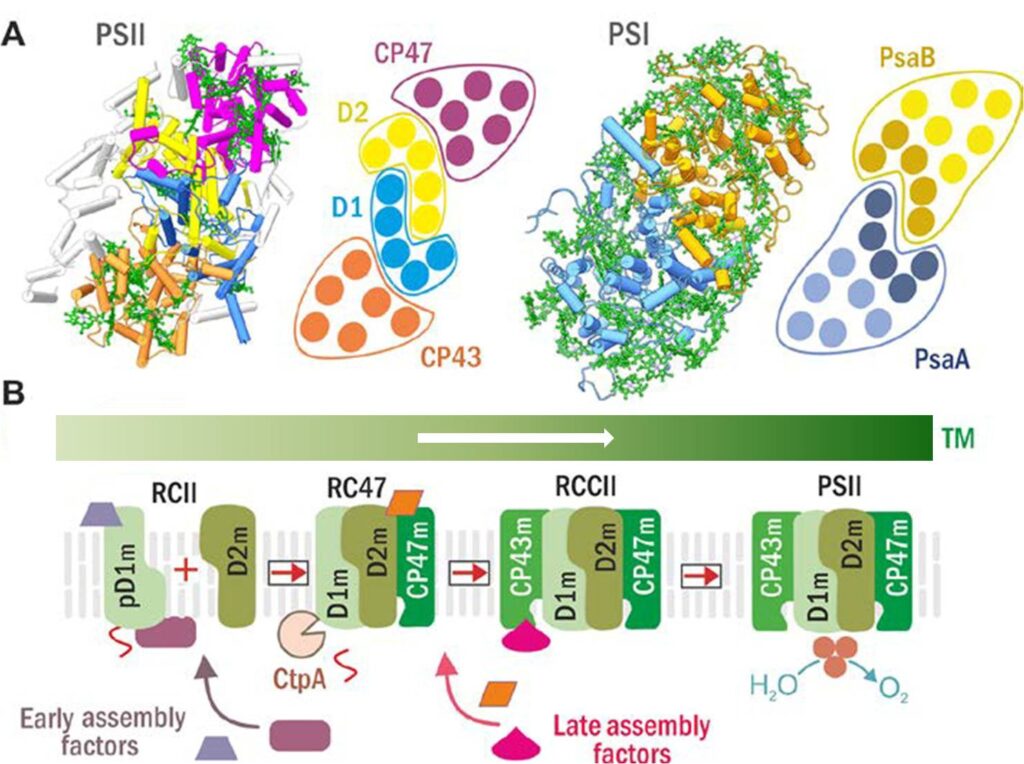
Obr. 1: Struktury PSII a PSI (A) a aktuální model sestavování PSII (B). (A) Struktura PSII (vlevo) a PSI (vpravo) a schematické helikální uspořádání jejich hlavních Chl-proteinů (D1 modře, D2 žlutě, CP47 fialově, CP43 hnědě; PsaA modře se šroubovicemi antény ve světle modré, a PsaB v okrové s anténními šroubovicemi ve světlé okrové). (B) Sestavení PSII probíhá krok po kroku, počínaje syntézou a zabudováním prekurzorového modulu D1 (pD1m) a pokračuje postupným připojením modulů D2, CP47 a CP43. Tvorba komplexu RCII je doprovázena maturací pD1 katalyzované CtpA proteázou. Předpokládá se, že iniciální procesy tvorby PSII jsou prostorově oddělené do specifických domén tylakoidní membrány, tzv. center biogeneze. Jak počáteční, tak pozdější kroky biogeneze PSII jsou facilitovány specifickými pomocnými faktory, které nejsou součástí funkčního PSII. (Z návrhu projektu Provázaná biogeneze ..; upraveno.)
Významným představitelem AF fotosystému II je protein Ycf48 (v rostlinách HCF136), který se na počátku biogeneze váže na nově syntetizovaný prekurzor pD1 a podporuje účinné spojení s proteinem D2 za vzniku subkomplexu reakčního centra (RCII) (Komenda et al., 2008). Kromě toho je Ycf48 potřebný pro efektivní nahrazení poškozeného D1 během opravy PSII (Obr. 3), a existují také důkazy o širší úloze v biogenezi fotosyntetického aparátu. 3D struktura Ycf48 odpovídá sedmilisté vrtuli s konzervovanou argininovou (Arg) doménou na povrchu proteinu, která je důležitá pro vazbu Ycf48 nejen na RCII, ale také na větší komplexy, včetně trimerního fotosystému I (PSI) (Yu et al., 2018). Ve spolupráci s našimi partnery jsme ve vysokém rozlišení vyřešili strukturu RCII tvořenou podjednotkami D1 a D2, PsbI a PsbE/F a Ycf48 (Zhao et al., 2023). Naše výsledky potvrdily, že se tento pomocný protein váže na lumenální povrch podjednotky D1 prostřednictvím Arg domény, a to přesně v místě, kde se ve funkčním PSII váže kyslík-vyvíjející Mn4CaO5 komplex. To pravděpodobně zabraňuje předčasnému navázání Mn2+ a Ca2+ iontů a tímto způsobem je klíčové vazebné místo chráněno před poškozením způsobeným světlem. Uvolnění Ycf48 z vazby na RCII je pak nezbytné pro světlem indukované sestavení manganového klastru. Model také naznačil interakci mezi Ycf48 a C-terminálním koncem D2, což pomáhá vysvětlit, jak Ycf48 podporuje navázání D1 a D2.
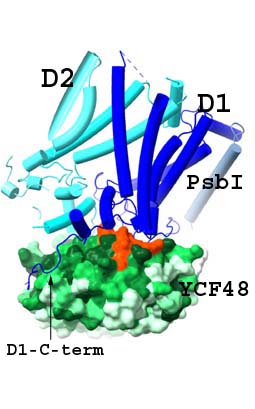
Obr. 2: Časný assembly factor Ycf48 (zelená) se váže na klíčovou podjednotku D1 (tmavě modrá) pomocí Arg domény (oranžová) v místě, kde je ve funkčním PSII vázán kyslík-vyvíjející Mn4CaO5 komplex. C-konec D1 proteinu (šipka), který se také účastní ligace manganového komplexu, je odkloněn od tohoto místa vazbou na povrch Ycf48. Toto uspořádání brání předčasnému navázání iontů Mn2+ and Ca2+ a chrání místo před světelným poškozením v průběhu biogeneze. Detailní studie viz Zhao et al. (2023).
Biogeneze fotosystému I
Na rozdíl od PSII jsou podrobné informace o sestavování PSI mnohem omezenější a to se týká zejména rané fáze procesu. Nedávno jsme dosáhli důležitého pokroku ve studiu této fáze sestavení PSI izolací hlavních podjednotek heterodimeru reakčního centra, PsaA a PsaB (Obr. 1), označených FLAG-tagem s využitím kmenů, kterým jedna či druhá podjednotka chybí (Gupta a Komenda, nepublikováno). Izolovaný PsaA obsahuje velké množství Chl, které zhruba odpovídá počtu Chl vázaných na PsaA ve funkčním trimeru PSI (Malavath et al. 2018). Naproti tomu izolovaný FLAG-PsaB vykazuje pouze velmi omezenou pigmentaci. Přítomnost některých malých membránových podjednotek PSI hovoří pro modulární princip sestavování, který je pravděpodobně společný pro PSI i PSII. Identifikovali jsme také řadu proteinů specifických pro každou hlavní podjednotku. Kromě již známých assembly faktorů (AF) jsme nalezli také dříve neidentifikované komponenty, potenciálně důležité pro tuto fázi sestavení PSI. Náš současný projekt Raná fáze biogeneze PSI .. je zaměřen na definování podrobného modelu a objasnění role malých podjednotek PSI a AF identifikovaných v časných meziproduktech PSI.


Provázaná biogeneze PSI a PSII
Asociace specifických meziproduktů PSII s monomerním či trimerním PSI (Bečková et al., 2017; Strašková et al. 2018; Kiss et al., 2019; Knoppová et al., 2022) nebo s enzymy chlorofylové dráhy (Dobáková et al. al., 2009 a nepublikované výsledky), stejně jako spojení Chl-syntázy, konečného enzymu biosyntézy Chl, s YidC inzertázou a Sec translokázou (Chidgey et al. 2014) naznačují, že tyto dva fotosystémy pravděpodobně sdílejí společný buněčný aparát integrující procesy vedoucí k tvorbě a zabudování Chl-proteinů se syntézou Chl (viz Provázaná biogeneze …). Předpokládáme existenci funkčních domén řídících nasměrování de novo vzniklých molekul Chl k podjednotkám PSI či PSII, tak jak se mění poměr PSI:PSII za různých podmínek prostředí, a také se domníváme, že navázání meziproduktů biogeneze fotosystému II na fotosystém I chrání vznikající PSII před světelným poškozením díky „přelévání“ (spillover) absorbované energie směrem na PSI.
Úloha FtsH proteáz při udržování fotosyntetických komplexů a odpovědi na abiotický stres
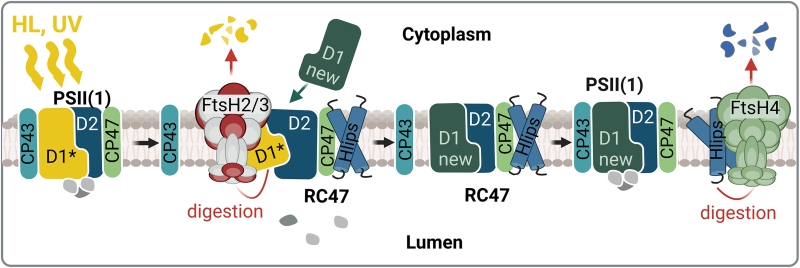
FtsH proteázy patří mezi intramembránové ATP-dependentní metaloproteázy, které nacházíme v prokaryotech, mitochondriích a chloroplastech. Většina sinic, včetně Synechocystis, má čtyři homology FtsH (FtsH1 až FtsH4). Sestavují se do tří oligomerních komplexů: dva heterooligomery FtsH1/3 a FtsH2/3 a jeden homooligomer FtsH4. Komplex FtsH1/3 se nachází v plazmatické membráně, zatímco hojnější FtsH2/3 a FtsH4 jsou lokalizovány v tylakoidních membránách. Bylo prokázáno, že FtsH1/3 u Synechocystis je rozhodující pro jemné doladění transkripční odpovědi na živinový stres. Na druhé straně, tylakoidní FtsH2/3 řídí selektivní degradaci podjednotek PSII během procesu opravy, což je základní mechanismus kompenzující poškození PSII nadměrným světlem, a tak hraje klíčovou roli při kontrole kvality komplexů PSII. Delece genu ftsH2 vede k abnormální citlivosti na světlo a k fotoinhibici PSII, ale také má za důsledek snížení hladiny PSI a obsahu buněčného Chl. Druhý tylakoidní komplex FtsH4 se podílí na biogenezi PSII a PSI a aklimatizaci na náhlé změny intenzity světla regulací hladiny proteinů indukovaných vysokým světlem (Hlips) zapojených do fotoprotekce vznikajících komplexů PSII. Pro recentní review viz Krynická and Komenda (2024).